窗体顶2020年新冠病毒(SARS-CoV-2)肆虐全球。这次疫情,将全球目光再一次聚焦到冠状病毒所属的囊膜病毒上,今年的诺贝尔生理学或医学奖颁给了丙肝病毒的发现者,是对常年坚持囊膜病毒的研究者们一次巨大鼓励。然而,普通大众对病毒的科普认知仍然存在误区,新冠病毒一度就是个“看不见的敌人”——因为看不见,所以有疏于防范的可能。
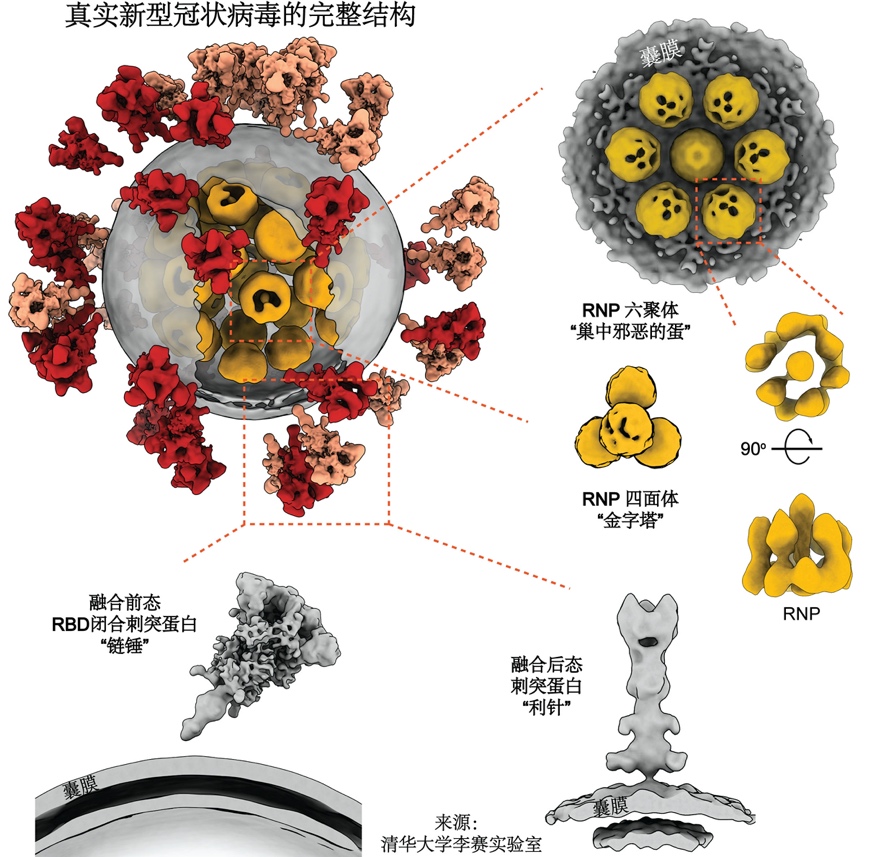
全球首次从内到外完整揭示新冠病毒全病毒精细结构
从今年1月起,清华大学生命学院研究员李赛便立下决心,向全球“招贴新冠病毒高清通缉照”。近日,该项目结出果实,李赛课题组和浙江大学医学院附属第一医院传染病诊治国家重点实验室李兰娟院士课题组紧密合作,利用冷冻电镜断层成像和子断层平均重构技术成功解析了新冠病毒(SARS-CoV-2)全病毒三维结构,这一重要研究成果于北京时间2020年9月15日以“新冠病毒的全分子结构”(Molecular architecture of the SARS-CoV-2 virus)为题在国际权威学术期刊《细胞》杂志上在线发表。

首次解析新冠全病毒分子结构
这项研究首次解析了新冠病毒全病毒的高分辨率分子结构,使世界对新冠病毒的认识更进一步,为抗击疫情、治疗新冠肺炎打下坚实全面的结构基础。在这项研究中,浙大团队提供了经严格灭活、含有新冠病毒的细胞培养液,保证了样品的天然结构。清华团队在二级实验室提纯浓缩病毒后,使用实验室开发的高通量、高分辨冷冻电镜断层成像技术(cryo-ET),采集了100TB数据,从中筛选出2294颗病毒颗粒(目前已知的新冠病毒最大cryo-ET数据集),并从病毒表面及体内挑选出5.5万个刺突蛋白和2万个核糖核蛋白复合物。利用这些数据,李赛团队重构出一颗具有代表性的完整病毒三维结构,分辨率最高达7.8Å。统计结果表明,新冠病毒囊膜平均直径约80纳米,表面约有30个刺突蛋白,内部约有30个核糖核蛋白复合物。
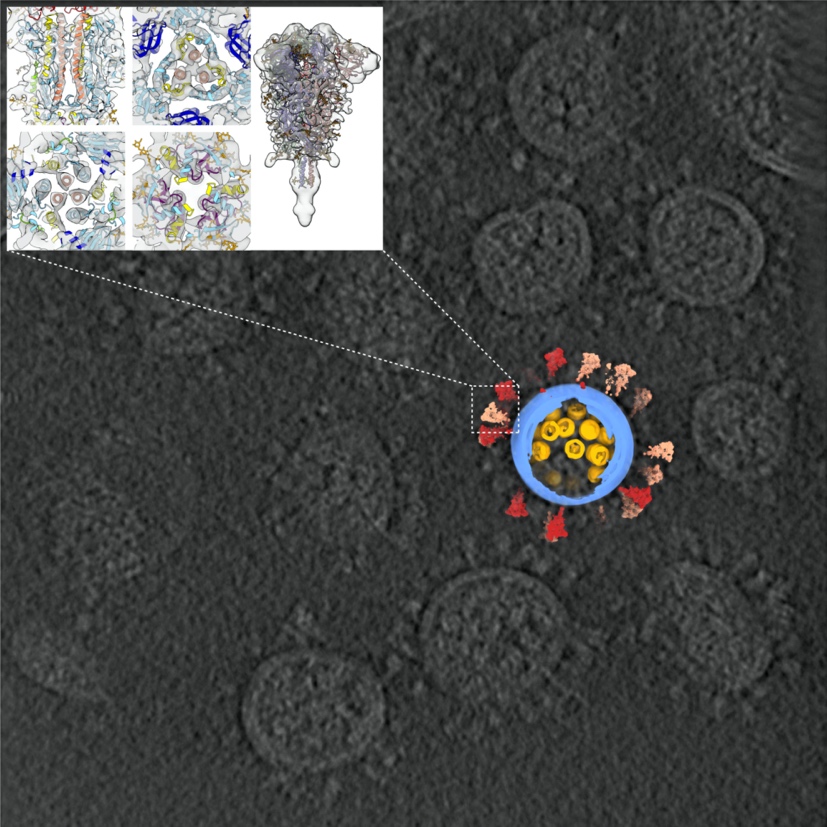
新冠病毒结构及冷冻电镜断层图像
原位状态下深度分析刺突蛋白结构
新冠病毒的“皇冠”特征,来源于它表面的刺突蛋白,凸起于病毒表面,是其侵入人体细胞的“钥匙”,目前大多数疫苗和抗体的研发均聚焦于该蛋白。
该研究解析出处于融合前状态及融合后状态的三种不同构象刺突蛋白结构。结果表明,刺突蛋白在病毒表面呈随机分布,且可自由摆动,类似于古代武器“链锤”,这种灵活的特性有利于“钥匙”及时调整方向,同细胞上更多的“锁”(受体)结合而增加侵染细胞几率。刺突蛋白也很脆弱,灭活和提纯方式不当可能导致其部分、甚至完全脱落,产生不正常的“秃”病毒。该发现为灭活病毒类疫苗提供了分子分辨率的结构及统计上的提示。
刺突蛋白表面有多达66个糖基化修饰,这些糖像盾牌一样保护病毒不被免疫识别。此前还没有对病毒上天然状态下糖基化修饰的详细研究。在清华大学蛋白质化学与组学平台的帮助下,该问题得到详细解答——相比于重组刺突蛋白,原位的糖基更大也更复杂,但总体而言相似性较大,这种相似性保证了重组刺突蛋白疫苗研发工作的有效性。
开创性揭示正义单链RNA病毒核糖核蛋白复合物天然结构及组装机制
新冠病毒的所有遗传信息都编码在其核糖核酸(RNA)上。病毒想要“繁衍”下一代,就必须保护好这根“生命之源”。冠状病毒的RNA是所有已知RNA病毒中最长的,其直线长度可达自身直径的100倍。如何把这根核酸“长绳”完整有序地缠绕进仅有数十纳米直径的体内,是所有病毒都要费劲解决的几何难题。这个重任主要落在核蛋白上,它像线轴一样收纳RNA,将其有序缠绕,并组装成称为核糖核蛋白复合物(RNP)的高级结构,才能将RNA完整塞进病毒体内。在病毒发生膜融合及去组装后,它又能有条不紊地释放RNA,让它顺利进行复制。这个包装方法及过程,不仅对于新冠病毒是个未解之谜,甚至在所有正义单链RNA病毒中也是几何谜题。
李赛课题组对病毒内近2万颗RNP进行了挑选和分析,开创性地展示了病毒腔内RNP的结构及组装机制。该复合物像串珠一样将RNA组织在一起,并在病毒体内呈现六聚“鸟巢”型和正四面体“金字塔”型两种局部排列,有序地收纳了RNA这根“长绳”,还增加了病毒在复杂环境中经受物理挑战的能力。这与研究较多的负义单链RNA病毒差别较大,是世界范围内首次“看清”正义单链RNA病毒的内部结构。
学界及社会反馈
这一真实的病毒三维图像让“看不见的敌人”清晰地展现在世人面前,首次让世界看到新冠病毒全病毒结构。法国科学院院士、著名结构病毒学家Felix A.Rey教授来信祝贺道:“这是一个里程碑式的工作”。
成果受到全球多家媒体报道或垂询。李赛课题组第一时间免费向全球分享所有结构,对疫苗及抗体研发、疫情防控宣传、科普教育、分子动力学模拟等有重要作用。

李赛课题组新冠课题攻关团队合影(从左至右:张哲源、宋雨桐、孙楚杰、李赛、陈勇、张佳星、徐家璐)
清华大学李赛研究员为本文的第一通讯作者(lead contact),浙江大学李兰娟院士为本文的共同通讯作者。姚航平(浙江大学)、宋雨桐(清华大学博士生)、陈勇(清华大学博士后)、吴南屏(浙江大学)、徐家璐(清华大学博士生)为并列第一作者。另外,李赛课题组的孙楚杰、张佳星、张哲源也参与了该工作。同时,该项工作得到了多位结构及病毒学专家的大力协助,包括清华大学施一公院士、英国南安普顿大学Max Crispin教授、清华大学雷建林博士。项目的顺利开展,得益于王宏伟教授、颜宁教授、王新泉教授、张林琦教授、丁强教授、李雪明教授的支持和讨论,同时也得到清华大学冷冻电镜平台、生物计算平台、蛋白质化学与组学平台的支持。研究工作得到清华大学人才启动经费、北京高精尖结构生物学创新中心、清华-北大生命联合中心的支持。
论文链接及DOI:
https://www.cell.com/cell/fulltext/S0092-8674(20)31159-4
https://doi.org/10.1016/j.cell.2020.09.018
供稿:生命学院
编辑:李华山
审核:程曦
文章来源 |清华大学新闻网
窗体底端