清华新闻网12月21日电 近日,清华大学生命科学学院研究员闫创业与澳大利亚新南威尔士大学研究员蒋鑫合作发布了关于抗癌药物靶点MCT1蛋白复合物的转运与小分子抑制机理的重要成果。该工作通过结构生物学和生物化学相结合的手段阐明MCT1的转运机理和小分子抗癌候选药物抑制机制,为进一步靶向MCTs的药物发现奠定了基础。
以乳酸、丙酮酸和酮体为代表的单羧酸是大多数哺乳动物细胞中的必需代谢产物,这些单羧酸代谢物的动态吸收和再分配主要由质子偶联的单羧酸转运蛋白完成(MCTs)。在已鉴定的MCTs中,MCT1是最早被发现且广泛分布在各组织细胞中、维持细胞基本稳态的重要亚型。在生理条件下,MCT1-4协同糖酵解型细胞和氧化型细胞之间的乳酸穿梭,这是不同组织中乳酸稳态的关键过程,对于肌细胞和神经细胞的能量代谢具有重要作用。MCTs的表达改变也与神经退行性疾病、癫痫、脑缺血等多种脑疾病密切相关。更重要的是,MCT1、2和4在多种癌症中的高表达与癌症的发展有密切关系。由MCT1和其他亚型共同介导的乳酸穿梭能够连接以糖酵解为主要产能方式(Glycolytic tumor cell)和以线粒体氧化为主要产能方式(Oxidative tumor cell)的癌细胞使其形成协同代谢,从而促进肿瘤的发生与发展(图1)。
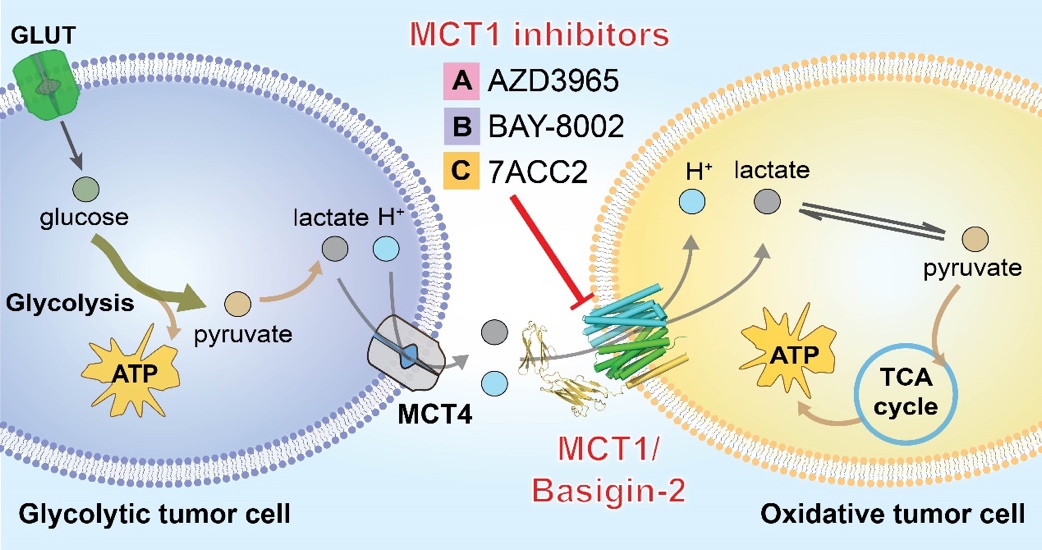
图1. MCT1-4介导的糖酵解型和氧化型肿瘤细胞之间的乳酸穿梭
由于其在癌症发生中的重要作用,MCT1被认为是重要的癌症治疗靶点。多个早期研究已指出抑制MCT1活性能够有效减缓癌细胞的生长和增殖,同时多个以MCT1为靶点的小分子抑制剂也被报道。然而,由于缺乏结构信息,MCT1的转运机理和小分子抑制剂的抑制机制一直未被阐明。
针对上述问题,闫创业和蒋鑫合作报道了MCT1和其伴侣蛋白Basigin-2在结合天然底物乳酸和不同小分子抑制剂的结构。通过对比野生型外向开口构象(Outward-facing conformation)的MCT1结构和模拟持续质子化的D309N突变体的内向开口构象(Inward-facing conformation)结构,研究人员阐明了MCT1的底物识别、质子偶联转运和交替开放机理。更进一步,文章通过解析MCT1/Basigin-2蛋白复合体与三个代表性小分子抑制剂AZD3965、BAY-8002和7ACC2的结构阐明了不同构象下小分子抑制剂与MCT1蛋白的结合模式(图2A)。
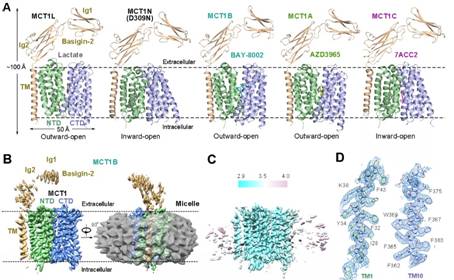
图2. MCT1/Basigin-2复合物与天然底物及三种经典小分子抑制剂在不同构象下的结构
作为一期临床实验中的先导化合物,AZD3965代表了最有希望成为抗癌药物的MCT1抑制剂。然而,由于AZD3965对于MCT1的选择性抑制,其对于MCT1和MCT4高表达的癌细胞杀伤效果欠佳。为了给进一步药物优化提供信息,研究人员根据MCT1/Basigin-2与AZD3965结合的复合物结构信息设计了一系列突变体,通过生化功能实验阐明了AZD3965对MCT亚型的选择性机理。由此,该工作通过结构生物学和生物化学相结合的手段阐明MCT1的质子偶联转运机制和小分子候选药物的抑制机理,为进一步靶向MCTs的药物发现奠定了基础。
值得一提的是,MCT1/Basigin-2复合物没有对称性且分子量只有大约80kDa,并且胞外区域比较柔性,只有50kDa的穿膜区比较稳定(图2B),这对冷冻电镜的结构解析形成了巨大挑战。为了解决这些技术难题,研究人员设计了一种“降噪-再加权”(noise reduction and re-weighting methods)的新型数据处理方法,结合之前开发的“引导性多参照三维分类”(guided multi-reference 3D classification)方法,以及新发展的优选颗粒辅助三维分类策略(Seed-facilitated 3D classification)有效消除了蛋白外的噪音信号,进一步突破了冷冻电镜解析非对称性膜蛋白样品的分子量下限,分辨率达到3Å(图2C、D)。这一方法将为进一步研究小分子量非对称性膜蛋白提供了新的思路。
该项研究成果于2020年12月16日在线发表在生命科学领域顶尖杂志《细胞》(Cell)上,题为“候选抗癌药物对人源单羧酸转运蛋白抑制机理的结构生物学研究” (Structural basis of human monocarboxylate transporter 1 inhibition by anti-cancer drug candidates)。
清华大学生命科学学院研究员闫创业和澳大利亚新南威尔士大学研究员蒋鑫为论文的共同通讯作者;清华大学生命科学学院2016级博士生王楠和新南威尔士大学研究员蒋鑫为共同第一作者;清华大学生命学院2017级博士生张硕和2019级博士生朱盎岐参与了数据收集和生化实验;清华大学生命学院博士后袁亚飞、技术员徐翰文对本研究提供了帮助;清华大学冷冻电镜平台主管雷建林博士为冷冻电镜数据收集提供了帮助。
实验的电镜数据采集得到清华大学冷冻电镜平台和西湖大学冷冻电镜平台的支持,实验的计算工作得到清华大学高性能计算平台、国家蛋白质设施实验技术中心(北京)的支持。本研究获得了国家自然科学基金重点研发计划、北京市科技新星计划、北京高校卓越青年科学家计划项目、清华大学结构生物学高精尖创新中心与清华-北大生命科学联合中心的经费支持。
论文链接:
https://doi.org/10.1016/j.cell.2020.11.043
供稿:生命学院
编辑:李华山
审核:吕婷
文章来源:清华大学新闻网